
单纯疱疹病毒(HSV)是人类最常见的病原体。其唯一的自然宿主,就是人类。因此,HSV在人群中的感染极为普遍,至今仍是尚未被攻克的医学难题,既无疫苗可用,也无药物可以根治。
HSV根据抗原特性不同可分为HSV-1和HSV-2两种血清型。HSV-1的感染可引起多种疾病。若眼角膜被HSV-1感染,会引起疱疹性基质性角膜炎(HSK),成为导致感染性失明的首要原因。
部分病毒性角膜炎患者能通过接收角膜移植恢复透明,但危机并未解除。HSV-1在角膜上皮原发性感染并生产复制后,会沿逆行方向通过眼神经到达三叉神经节。在那里,它们建立了一个病毒贮库。一旦重新激活,疾病便会复发和恶化。在全球范围内,估计每年有150万个角膜HSV复发案例,至少造成4万人失明。
失而复得,得而复失。如何在保证安全的基础上,直接降解病毒的基因组,甚至从根源上“剔”除潜伏的HSV,就成了亟待解决的问题。
日前,上海交通大学系统生物医学研究院蔡宇伽教授和复旦大学附属眼耳鼻喉科医院洪佳旭副主任医师的通力合作在基因编辑治疗领域取得重大突破。相关成果和操作技术在国际顶尖学术期刊《自然-生物医学工程》(Nature Biomedical Engineering)和《自然-生物技术》(Nature Biotechnology )杂志上接连发表。


今天,成果新闻发布会在眼耳鼻喉科医院举行。上海市科学技术委员会副主任朱启高,复旦大学党委副书记、上海医学院党委书记袁正宏,上海交通大学系统生物医学研究院院长韩泽广,复旦大学附属眼耳鼻喉科医院党委书记钱飚、院长周行涛,以及文章通讯作者蔡宇伽、洪佳旭,和第一作者尹笛、凌思凯、周旭娇等出席。发布会由眼耳鼻喉科医院副院长徐格致主持。




原创性基因治疗递送载体解决最大技术瓶颈
随着生物技术的不断发展,很多技术得以运用到人类相关疾病的治疗之中。其中,基因编辑技术发展至今已有近30年的历史,为从根本层面上解决疾病成因提供了可能性。要能实现精确的基因编辑以达到治疗效果,不仅需要合适的基因编辑工具,更需要高效且瞬时的递送技术,将工具准确地引导至作用靶点,以确保治疗的安全性和有效性。
而目前,相对于基因编辑工具的快速进化,递送技术的发展却极其缓慢而困难。研究团队以此为核心问题,通过将利用基因编辑和递送技术的融合,发明了全球首创的原创性基因治疗递送载体——类病毒体-mRNA(VLP-mRNA)。作为一种慢病毒载体,它可以高效感染几乎所有的细胞,而其中的非病毒成分mRNA又具备瞬时性的特点。该技术解决了让基因编辑体细胞治疗的最大技术瓶颈——递送技术,有望打通基因编辑体内治疗的最后一公里。
利用该递送技术,蔡宇伽和洪佳旭研究团队进行了CRISPR基因编辑治疗病毒性角膜炎的临床前研究,在急性和复发感染的小鼠模型中实现了从角膜到三叉神经节的逆行运输,终于将潜藏在神经节的HSV-1病毒库清除。
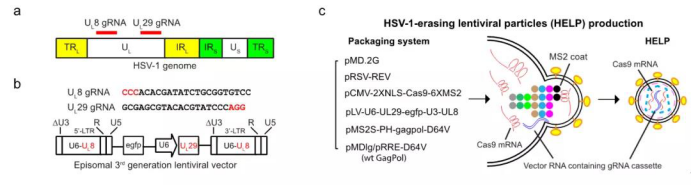
HELP的工作原理及其生产过程
为了证明治疗技术的抗病毒效果,研究团队采用了预防型、治疗型和复发型三种不同的小鼠感染模型,并发现,在这三种不同的HSV感染模型上,HSV-1的复制均得到了有效阻止,防止了疱疹性基质性角膜炎的发生。此外,研究者利用捐献者角膜也观察到该技术可以有效的清除HSV-1病毒。
该项治疗技术的英文全称是“HSV-1-Erasing Lentiviral Particles”。于是,研究团队将其命名为“HELP”,即“帮助”,期待这种全新的抗病毒疗法能够帮助难治性病毒性角膜炎患者,给他们有机会重获光明。
全新疗法有望解决临床难题实现从0-1的突破
随着基因编辑工具的不断发展,如何将这些工具更好地递送进入病灶内,并降低这些工具在细胞中产生的长期风险,成为基因治疗领域日益凸显的新挑战。研究团队此次开发的新技术,创新性地将病毒颗粒(VLP)和基因编辑工具的递送结合起来,在病毒性角膜性的动物模型中实现了有效且安全的基因编辑。
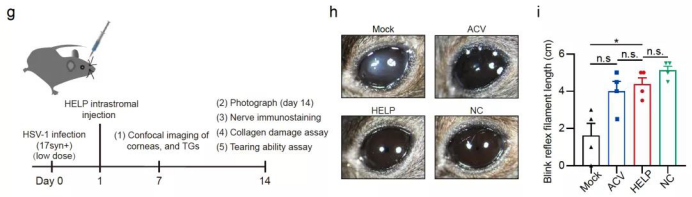
HELP在病毒感染的治疗模型上的治疗效果展示
“不仅解决了传统递送平台存在的尺寸限制,且将基因编辑工具的表达载体由长期存在的DNA替换成了瞬时表达的mRNA,极大地提高了工具使用的灵活性和安全性。”特邀评论员、阿斯利康(瑞典)基因治疗项目高级科学家李松沅博士总结道。
病毒性角膜炎并非无药可医,但无论是阿昔洛韦(ACV)等小分子抗病毒药物,还是角膜移植,都无法对潜伏的疱疹病毒库起到任何限制作用,使其成为难以根治之症。该项研究便为此类顽疾提供了全新的解决思路。
作为我国首个基因治疗方面的原创性抗病毒新技术,从细胞水平研究到动物水平研究,再到捐献者角膜研究,都实现了步骤完备、论证可靠的临床前研究。HELP技术以mRNA的形式完成CRISPR/Cas9的工具递送,使得基因编辑酶Cas9在体内的停留时间很短,可最大限度地降低脱靶风险、减少免疫反应。
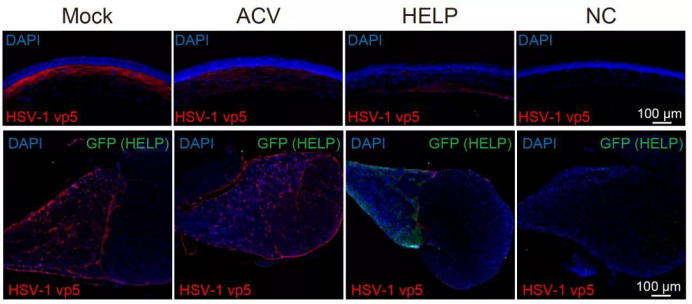
HELP清除角膜内与三叉神经节内的疱疹病毒
正如特邀评论员、中山大学中山眼科中心副主任袁进教授所言,将基因编辑运用于单疱病毒性角膜炎的治疗是从0到1的创新突破。该研究证实,在单疱病毒性角膜炎动物模型上通过基因编辑可抑制HSV病毒的转运和复制,有希望成为一种病毒性角膜炎的全新疗法,解决病毒性角膜炎复发这一临床难题。
这些结果都有力地支持了HELP作为一种新的抗病毒疗法的临床潜力,将帮助体内基因编辑治疗时代的真正到来,为无药可治有药难治的遗传性、获得性以及感染性疾病的患者带来新的希望。
从患者实际需求出发让基础研究和临床医学的发展实现碰撞

通讯作者蔡宇伽介绍论文主要创新点
“本来,我一直在试图解决一个基础研究领域的科学问题:能否利用CRISPR在动物模型上治愈病毒性角膜炎。但技术如何作用于临床,我无法确定,与洪主任的合作让接下来的进步成为可能。”蔡宇伽教授谈道。

通讯作者洪佳旭介绍论文主要创新点
“对于技术的应用场景,如何发现并验证它不只在治疗方面起作用,也在预防方面起作用,蔡教授主导补充的模型实验提供了更多的支持,背后是巨大的工作量和研究积累。”洪佳旭副主任医师回顾道。

论文作者团队
追溯合作的缘分起点,是2019年一场学术论坛上的一次交流。深耕基因编辑领域数年的二人互取优势,考虑到眼部器官的相对独立性、病毒性角膜炎的无法治愈性和疾病与技术的适配性,研究团队将合作聚焦于此。长期以来,眼耳鼻喉科医院眼科临床诊疗方面居于国内领先水平,丰富的临床资源为此次合作的顺利开展奠定了重要基础。此次科研成果的重大突破有望为角膜盲患者带来新的福音。
目前,在复旦大学附属眼耳鼻喉科医院伦理委员会的论证及许可下,洪佳旭团队正在主持开展基于本项技术的初期可控的临床应用研究。未来或将应用拓展至其他遗传性眼科疾病的治疗上。
我要评论 (网友评论仅供其表达个人看法,并不表明本站同意其观点或证实其描述)
全部评论 ( 条)